Page Contents
Toggleপানি যেমন আমাদের জীবন ধারণের অপরিহার্য একটি উপাদান, বাতাস ও কিন্তু তাই। আমরা বাতাসের মধ্যেই বসবাস করি, ক্রমাগত নিঃশ্বাস নেই।.দেখতে না পেলেও, বাতাসের প্রবাহ কিন্তু আমরা ঠিকই অনুভব করি। ঝড়ের সময় আমরা টের পাই অদৃশ্য বাতাসের দানবীয় শক্তি। আচ্ছা, বাতাসেরও কি দূষণ হতে পারে???
নবম শ্রেনীর বিজ্ঞান অনুশীলন বইয়ের শিখন অভিজ্ঞতা– বায়ু দূষণ’- এর মধ্য দিয়ে আমরা পদার্থের অবস্থা,কণার গতিতত্ব,ব্যাপন,নিঃসরণ,পরমাণুর মডেল, ইলেক্ট্রন বিন্যাস, আপেক্ষিক পারমাণবিক ভর,পর্যায় সারণি,মৌলের পর্যায়ভিত্তিক ধর্ম, রাসায়নিক বন্ধন,ধাতু নিষ্কাশন ইত্যাদি সম্পর্কে জানবো।
প্রথম ও দ্বিতীয় সেশনঃ
|
ক্রমিক নং |
দলের সদস্যের নাম |
এলাকার কোথায় নিঃশ্বাস নিতে ভালো লাগে |
এলাকার কোথায় নিঃশ্বাস নিতে খারাপ লাগে |
কোনো বিশেষ সাদৃশ্য বা বৈসাদৃশ্য |
|
১ |
হামিম |
নার্সারী |
বন্দর এলাকা |
নার্সারী |
|
২ |
সোহান |
উন্মুক্ত স্থান |
শিল্প এলাকা |
উন্মুক্ত স্থাণের |
|
৩ |
আলভী |
গাছপালা সমৃদ্ধ |
মহাসড়ক |
মহাসড়কে মানসিক |
|
৪ |
আকাশ |
জলাশয় যেমন |
ডাস্টবিনের |
ডাস্টবিনের আশেপাশের |
|
৫ |
সাদী |
স্কুল |
খাল বা নদীর তীরে |
দু’টো যায়গায়ই শান্ত পরিবেশ থাকতে পারে |
যেসব স্থানে শ্বাস নিতে আরাম লেগেছে সেখানে বিশেষ কি আছে?
পরিষ্কার বায়ু,পরিষ্কার জল, উর্বর মাটি, শান্ত পরিবেশ, পরিবেশের উপর ইতিবাচক প্রভাব ইত্যাদি।
যেসব স্থানে শ্বাস নিতে কষ্ট হয় সেখানের বিশেষ কি বৈশিষ্ট্য আছে?
বায়ু দূষন, পানি দূষন, মাটি দূষন, শব্দ দূষন, মানব স্বাস্থ্যের উপর নেতিবাচক প্রভাব ইত্যাদি।
তৃতীয়,চতুর্থ ও পঞ্চম সেশনঃ
যে অঞ্চলে বাতাস দূষিত সেখানে মানুষের কী কী অসুবিধা হচ্ছে?
- শ্বাসকষ্ট, হাপানি,কাশি,ব্রংকাইটিস, নিউমোনিয়ার মত রোগ সৃষ্টি করে।
- এজমা আক্রমণের শংকা বাড়ায়।ফুসফুসের ক্যান্সার,হৃদরোগ, রক্তজমাট বাঁধা ইত্যাদি রোগের ঝুকি বাড়ায়।
- ত্বকের সমস্যা,চোখের সমস্যা, স্মৃতিশক্তি হ্রাস ইত্যাদি সমস্যা সৃষ্টি করে।
- গর্ভকালিন জটিলতা এবং শিশুদের বিকাশে বাঁধা সৃষ্টি করতে পারে।
- এছাড়াও মানসিক চাপ, উদ্বেগ, বিষন্নতার মত মানসিক স্বাস্থ্যের সমস্যা তৈরী করতে পারে।
উদ্ভিদ ও প্রাণি,মানবস্বাস্থ্য ও প্রাকৃতিক পরিবেশের উপর বায়ু দূষণের প্রভাবঃ
| বায়ু দূষনের ফলাফল |
মানুষের স্বাস্থ্যের উপর প্রভাব | শ্বাসকষ্ট, হাপানি,কাশি,ব্রংকাইটিস, নিউমোনিয়ার মত রোগ সৃষ্টি করে।এজমা আক্রমণের শংকা বাড়ায়। ফুসফুসের ক্যান্সার,হৃদরোগ, রক্তজমাট বাঁধা ইত্যাদি রোগের ঝুকি বাড়ায়।ত্বকের সমস্যা,চোখের সমস্যা, স্মৃতিশক্তি হ্রাস ইত্যাদি সমস্যা সৃষ্টি করে।গর্ভকালিন জটিলতা এবং শিশুদের বিকাশে বাঁধা সৃষ্টি করতে পারে। এছাড়াও মানসিক চাপ, উদ্বেগ, বিষন্নতার মত মানসিক স্বাস্থ্যের সমস্যা তৈরী করতে পারে। |
অন্যান্য উদ্ভিদ ও প্রাণির উপর প্রভাব | উদ্ভিদের উপর প্রভাবঃ উদ্ভিদের বৃদ্ধি ব্যহত হয়।ফুল ও ফলের বিকাশে বাঁধা সৃষ্টি করে, ফলে ফলন কমে যায়। সালোকসংশ্লেষণ প্রক্রিয়া ব্যহত হয় এবং পাতা ঝরতে পারে। প্রাণীর উপর প্রভাবঃ প্রাণীর রোগ প্রতিরোধ ক্ষমতা কমে যায়। প্রজনন ক্ষমতা হ্রাস করতে পারে। প্রাণীর বৃদ্ধি ব্যাহত হতে পারে। ফুসফুসের বিভিন্ন সমস্যা দেখা দিতে পারে। |
প্রাকৃতিক পরিবেশের উপর প্রভাব | গ্রিন হাউস গ্যাস বৃদ্ধি পায়, ফলে পৃথিবীর তাপমাত্রা বৃদ্ধি পায়। এসিড বৃষ্টি তৈরি হয়। এটি বন,জলাশয় এবং মাটির ক্ষতি হয়।ওজোন স্তর ক্ষয় করে।জীববৈচিত্র্য হ্রাস পায়। |
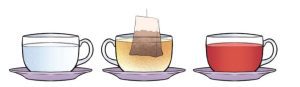
পরীক্ষনঃ পানিতে চা’পাতার রং ছড়িয়ে পরা।
| টি ব্যাগ ডোবানোর সাথে সাথে | ১ মিনিট পর | ২ মিনিট পর | ৫ মিনিট পর |
পানির রং | পানির কিছু অংশ হালকা বাদামী | হালকা বাদামী | গাঢ় বাদামী | গাঢ় বাদামী বা কালচে |
| বেলুনের বাতাস বের হয়ে যাওয়ার গতি | কারণ ব্যাখ্যা |
সাধারণ অবস্থায় বেলুন ফুটো করলে | দ্রুত | বেলুনের ভেতরে বাতাসের চাপ বাইরের বাতাসের চাপের চেয়ে বেশি থাকে। ফলে, যখন বেলুনে ফুটো হয়, তখন বেলুনের ভেতরের উচ্চচাপের বাতাস দ্রুত বাইরের নিম্নচাপের দিকে প্রবাহিত হয়। বেলুনের ভেতরের বাতাসের অণুগুলো গতিশীল থাকে। ফলে, ফুটো দিয়ে বের হওয়ার সময় তাদের গতি আরও বৃদ্ধি পায়। |
স্কচটেপ লাগিয়ে তার ওপরে বেলুন ফুটো করলে | ধীরে | বেলুনে স্কচটেপ লাগিয়ে তার উপরে বেলুনে ফুটো করলে বাতাস বের হয়ে যাওয়ার গতি ধীর হওয়ার কারণ হলো স্কচটেপের প্রতিরোধ ক্ষমতা। স্কচটেপ বেলুনের ছিদ্রটিকে পুরোপুরি বন্ধ করে না, বরং ছিদ্রের চারপাশে একটি পাতলা আবরণ তৈরি করে। এই আবরণ বাতাসের প্রবাহকে বাধা দেয়, ফলে বাতাস ধীরে ধীরে বের হয়।এক্ষেত্রে বেলুনটি ফেটে যায়না,চুপসে যায়। |
বাতাসে সুগন্ধ বা দুর্গন্ধ ছড়ানোর সাথে এই দুইটি ঘটনার কোনটির মিল পাওয়া যায়?
বাতাসে সুগন্ধ বা দুর্গন্ধ ছড়ানোর সাথে পানিতে চাপাতার রং ছড়িয়ে পড়ার ঘটনার সাথে মিল রয়েছে।দুটো ঘটনাতেই ব্যাপন ঘটে।
বাতাস দূষিত হয় কোন প্রক্রিয়ায়?দূষণকারী পদার্থ কীভাবে ছড়ায়?তরল ও কঠিন পদার্থেও কি একইভাবে দূষণ ঘটে?
- কলকারখানার বর্জ্য পানি নদীতে ফেলা,
- কৃষি ক্ষেত থেকে রাসায়নিক সার ও কীটনাশক ধুয়ে নদীতে চলে যাওয়া,
- পয়ঃনিষ্কাশনের অব্যবস্থা ইত্যাদি।
- প্লাস্টিকের স্তর
- ইলেকট্রনিক বর্জ্য
- বিষাক্ত রাসায়নিক পদার্থ ইত্যাদি।
পদার্থের এক অবস্থা থেকে অন্য অবস্থায় পরিবর্তন কীভাবে ঘটে?
গলন,স্ফুটন, পাতন,ঊর্ধ্বপাতন প্রক্রিয়া বলতে কী বুঝ?
গলন, স্ফুটন, পাতন, এবং ঊর্ধ্বপাতন প্রক্রিয়া:
ষষ্ঠ সেশনঃ
কোন কোন পদার্থ বায়ুতে থাকলে বায়ু দূষিত হয়? এসব পদার্থের ধরন কেমন?
বায়ু দূষনকারী পদার্থ | পদার্থের ধরন |
ক্ষুদ্র বস্তুকণা (PM) | বায়ু দূষণের অন্যতম উপাদান, যার সাথে অনেক স্বাস্থ্যঝুঁকি জড়িত। এসব বস্তুকণায় বিভিন্ন উপাদান পাওয়া যায়; যেমন সালফেট ও নাইট্রেট যৌগ, অ্যামোনিয়া, সোডিয়াম ক্লোরাইড, কার্বন, ধূলিকণা এবং জলীয় বাষ্প। |
কার্বন মনোক্সাইড (CO) | বর্ণহীন, স্বাদহীন, গন্ধহীন বিষাক্ত গ্যাস; মূলত কার্বনভিত্তিক ফুয়েল (যেমন: কাঠ, পেট্রোল, কয়লা, প্রাকৃতিক গ্যাস, কেরোসিন ইত্যাদি) পোড়ানোর ফলে উৎপন্ন হয়। |
নাইট্রোজেন ডাই অক্সাইড (NO2) | মূলত যানবাহনের ধোঁয়া এবং শিল্প কারখানা থেকে উৎপন্ন হয় এই ক্ষতিকর গ্যাস। |
সালফার ডাই অক্সাইড (SO2) | বর্ণহীন কিন্তু কড়া ঘ্রাণযুক্ত গ্যাস।সাধারণত ফসিল ফুয়েল পোড়ানোর ফলে বাতাসে মেশে। |
পরমাণুর বিন্যাস সম্পর্কে রাদারফোর্ডের মডেলের মুল ধারণা কী? | ১.পরমাণুর কেন্দ্রে একটি ধনাত্মক চার্জযুক্ত ক্ষুদ্র কেন্দ্র থাকে,রাদারফোর্ড যার নাম দেন নিউক্লিয়াস। এই নিউক্লিয়াসে প্রোটন এবং নিউট্রন থাকে।পরমাণুর অধিকাংশ জায়গাই ফাঁকা। ২. ইলেকট্রন, যা ঋণাত্মক চার্জযুক্ত কণা, নিউক্লিয়াসের চারদিকে নির্দিষ্ট কক্ষপথে ঘোরে। ৩. সৌরজগতে যেমন সূর্যকে কেন্দ্র করে গ্রহগুলো ঘুরে তেমনি নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষপথে ইলেকট্রনগুলো ঘুরতে থাকে। নিউক্লিয়াস এবং ইলেকট্রনের মধ্যে আকর্ষণ বল কাজ করে, যা পরমাণুকে স্থিতিশীল রাখে।
|
পরমাণুর বিন্যাস সম্পর্কে বোরের মডেলের মুল ধারণা কী? | ১.পরমাণুতে থাকা ইলেকট্রনগুলো নিউক্লিয়াসকে কেন্দ্র করে ইচ্ছেমতো যে কোনো কক্ষপথে ঘুরতে পারে না, শুধু নির্দিষ্ট ব্যাসার্ধের কতগুলো অনুমোদিত বৃত্তাকার কক্ষপথে ঘুরে থাকে। এদেরকে প্রধান শক্তিস্তর বলে,যা n দ্বারা প্রকাশ করা হয়।এই স্থিতিশীল কক্ষপথে ঘোরার সময় ইলেকট্রনগুলো কোনো শক্তি শোষণ বা বিকিরণ করে না। ২. শক্তিস্তরে ইলেকট্রনের স্থানান্তরের ফলে শক্তি শোষিত বা বিকিরিত হয়। এই শোষিত বা বিকিরিত শক্তির পরিমাণ, দুটি শক্তিস্তরের (E1, E₂) শক্তির মধ্যে পার্থক্যের সমান এবং এটি প্লাঙ্কের সমীকরণ দ্বারা নির্ধারিত হয়। সমীকরণটি এরকম : ΔΕ = E₂ – E1 = hυ |
এই দুই মডেলের মূল পার্থক্য কোথায়? | রাদারফোর্ডের মডেল পরমাণুর কেন্দ্রীয় কাঠামো সম্পর্কে ধারণা দান করে, যেখানে বোরের মডেল ইলেকট্রনের কক্ষপথ এবং শক্তিস্তর এবং বর্ণালী সম্পর্কে ধারণা প্রদান করে। |
সপ্তম ও অষ্টম সেশনঃ
পরমাণুতে ইলেক্ট্রন কিভাবে বিন্যাস্ত থাকে?
পরমাণুতে ইলেকট্রন বিন্যাস :
পরমাণুতে নিউক্লিয়াসকে কেন্দ্র করে যে শক্তিস্তরে ইলেকট্রন ঘুরে তাকে প্রধান শক্তিস্তর বলে, একে n দ্বারা প্রকাশ করা হয়। n = 1,2,3,4 ইত্যাদি।
প্রত্যেকটি প্রধান শক্তি স্তরের সর্বোচ্চ ইলেকট্রন ধারণ ক্ষমতা হলো 2n2
n= 1, হলে ১ম কক্ষপথে সর্বোচ্চ( 2*12=2) ২টি ইলেকট্রন থাকতে পারে।অনুরূপভাবে ২য়,৩য়, ৪র্থ শক্তিস্তরে ইলেকট্রন ধারণ ক্ষমতা হবে ৮,১৮,৩২টি।
দলীয় কাজঃ পরমাণুর ইলেক্ট্রন বিন্যাস বের কর।
|
পারমাণবিক সংখ্যা |
মৌল |
n= 1 K সর্বোচ্চ 2 টি ইলেক্ট্রন |
n= 1 L সর্বোচ্চ 8 টি ইলেক্ট্রন |
n= 1 M সর্বোচ্চ 18 টি ইলেক্ট্রন |
n= 1 N সর্বোচ্চ 32 টি ইলেক্ট্রন |
|
1 |
H |
1 |
|
|
|
|
2 |
He |
2 |
|
|
|
|
3 |
Li |
2 |
1 |
|
|
|
4 |
Be |
2 |
2 |
|
|
|
5 |
B |
2 |
3 |
|
|
|
6 |
C |
2 |
4 |
|
|
|
7 |
N |
2 |
5 |
|
|
|
8 |
O |
2 |
6 |
|
|
|
9 |
F |
2 |
7 |
|
|
|
10 |
Ne |
2 |
8 |
|
|
|
11 |
Na |
2 |
8 |
1 |
|
|
12 |
Mg |
2 |
8 |
2 |
|
|
13 |
Al |
2 |
8 |
3 |
|
|
14 |
Si |
2 |
8 |
4 |
|
|
15 |
P |
2 |
8 |
5 |
|
|
16 |
S |
2 |
8 |
6 |
|
|
17 |
Cl |
2 |
8 |
7 |
|
|
18 |
Ar |
2 |
8 |
8 |
|
|
19 |
K |
2 |
8 |
8 |
1 |
|
20 |
Ca |
2 |
8 |
8 |
2 |
|
21 |
Sc |
2 |
8 |
9 |
2 |
|
22 |
Ti |
2 |
8 |
10 |
2 |
|
23 |
V |
2 |
8 |
11 |
2 |
|
24 |
Cr |
2 |
8 |
13 |
1 |
|
25 |
Mn |
2 |
8 |
13 |
2 |
|
26 |
Fe |
2 |
8 |
14 |
2 |
|
27 |
Co |
2 |
8 |
15 |
2 |
|
28 |
Ni |
2 |
8 |
16 |
2 |
|
29 |
Cu |
2 |
8 |
18 |
1 |
|
30 |
Zn |
2 |
8 |
18 |
2 |
উপশক্তিস্তরের ধারণা ঃ
ইলেকট্রন বিন্যাসের নীতি (আউফবাউ নীতি) কী?
ইলেকট্রন বিন্যাসের ব্যাতিক্রম ঃ ভাবনার খোরাক
Cu (29) → 1s2 2s2 2p6 3s2 3p6 4s1 3d10
Cr (24) → 1s2 2s2 2p6 3s2 3p6 4s1 3d5
নবম ও দশম সেশনঃ
পারমাণবিক ভর ও আপেক্ষিক পারমাণবিক ভরের পার্থক্য কি?
পার্থক্য –
প্রকৃতিতে কপারের দুটি আইসোটোপ হচ্ছে 63Cu এবং 65Cu এবং তার গড় আপেক্ষিক পারমাণবিক ভর হচ্ছে 63.5। তুমি কি 63Cu এবং 65Cu –এর প্রকৃতিতে প্রাপ্ত শতকরা পরিমাণ বের করতে পারবে?
হ্যাঁ, আমি 63Cu এবং 65Cu –এর প্রকৃতিতে প্রাপ্ত শতকরা পরিমাণ বের করতে পারবো।
প্রথমে, আমরা নিম্নলিখিত সমীকরণটি ব্যবহার করবো:
গড় পারমাণবিক ভর = (আইসোটোপ 1 এর ভর * আইসোটোপ 1 এর শতকরা পরিমাণ) + (আইসোটোপ 2 এর ভর * আইসোটোপ 2 এর শতকরা পরিমাণ) / 100
গড় পারমাণবিক ভর = (pm+qn)/100
এখানে,
- গড় পারমাণবিক ভর = 63.5
- আইসোটোপ 1 = 63Cu
- আইসোটোপ 2 = 65Cu
- আইসোটোপ 1 এর ভর m = 62.9295 u
- আইসোটোপ 2 এর ভর n = 64.9277 u
- আইসোটোপ 1 এর শতকরা পরিমাণ p = x
- আইসোটোপ 2 এর শতকরা পরিমাণ q= 100 – x
এখন, আমরা সমীকরণটিতে মানগুলি প্রতিস্থাপন করবো:
63.5 = (62.9295 * x) + (64.9277 * (100 – x)) / 100
এই সমীকরণটি সমাধান করলে আমরা পাই: x = 71.44%
অতএব,
63Cu –এর শতকরা পরিমাণ = 71.44%
65Cu –এর শতকরা পরিমাণ = 100 – 71.44 = 28.56%
সুতরাং, 63Cu –এর প্রকৃতিতে প্রাপ্ত শতকরা পরিমাণ 71.44% এবং 65Cu –এর প্রকৃতিতে প্রাপ্ত শতকরা পরিমাণ 28.56%।
৩টি আইসোটোপ রয়েছে এরকম একটি মৌলের গড় আপেক্ষিক পারমাণবিক ভর যদি তুমি জানো তাহলে কি তুমি তাদের প্রকৃতিতে প্রাপ্ত শতকরা পরিমাণ বের করতে পারবে?
গড় পারমাণবিক ভর = (pm+qn+ro)/100
এখানে p,q,r হলো যথাক্রমে ৩টি আইসোটোপের শতকরা পরিমাণ এবং m,n,o হলো আইসোটোপ ৩টির ভর।
এই সূত্রে মান বসিয়ে প্রকৃতিতে প্রাপ্ত আইসোটোপের শতকরা পরিমাণ বের করতে পারব।
১১শ ও ১২শ সেশনঃ
আপেক্ষিক আণবিক ভর কিভাবে বের করা হয়?
১৩শ,১৪শ,১৫শ ও ১৬শ সেশনঃ
পর্যায় সারণি কী?
পর্যায় সারণিতে মৌলের অবস্থান নির্ণয় কিভাবে করবে?
B (5) → 1s2 2s2 2p1
সুতরাং, বোরনের গ্রুপ নম্বর হবে (2+1+10)=13
নিয়ম ৩: কোন মৌলের ইলেকট্রন বিন্যাসের বাইরের প্রধান শক্তিস্তরে s অরবিটাল থাকলে এবং এর আগে d অরবিটাল থাকলে সেক্ষেত্রে s এবং d অরবিটালের ইলেকট্রন সংখ্যা যোগ করলে যে সংখ্যা পাওয়া যাবে সেটি হবে মৌলের গ্রুপ নাম্বার।Fe (26) → 1s2 2s2 2p6 3s2 3p6 4s2 3d6
এক্ষেত্রে, আয়রন (Fe) -এর বাইরের প্রধান শক্তিস্তরে ও অরবিটাল আছে এবং তার আগের প্রধান শক্তিস্তরে d অরবিটাল আছে। এখানে d অরবিটালে, এটি এবং ও অরবিটালে 2টি ইলেকট্রন রয়েছে। সুতরাং, আয়রন (Fe) -এর গ্রুপ নম্বর হবে 6+2=8
নিচের মৌলগুলোর পর্যায়সারণিতে অবস্থান নির্ণয় কর।
K (19) → 1s2 2s2 2p6 3s2 3p6 4s1 ;পর্যায় ৪, গ্রুপ ১
Zn(30) → 1s2 2s2 2p6 3s2 3p6 4s2 3d10 ;পর্যায় ৪, গ্রুপ ১২
Rb(37) →1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 ;পর্যায় ৫, গ্রুপ ১
Sb(51) →1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3 ;পর্যায় ৫, গ্রুপ ১৫
Ba(56) → 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 ;পর্যায় ৬, গ্রুপ ২
Au (79) →1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d9 ;পর্যায় ৬, গ্রুপ ১২
পারমাণবিক আকার অনুযায়ী Ca,Br,Ds,O,Xe,Mg,Cr,Au,Ni,Si,Fr,F মৌলগুলোকে সাজাও
যোজনী ও যোজ্যতা কি?
১৯শ ও ২০শ সেশনঃ
একটি পদার্থ আরেকটি পদার্থের সাথে কেন যুক্ত হয়? কোন মৌল কোন মৌলের সাথে মিলে যৌগ গঠন করবে তা কিসের উপর নির্ভর করে?
আয়নিক বন্ধন, সমযোজী বন্ধন, ধাতব বন্ধন: কোন ক্ষেত্রে কোনটি ঘটে? কীভাবে ঘটে?
আয়নিক বন্ধন কীভাবে ঘটে:
সমযোজী বন্ধন কীভাবে ঘটে:
ধাতব বন্ধন কীভাবে ঘটে:
বায়ু দূষণকারী পদার্থগুলোর মধ্যে কোন ধরণের বন্ধন কাজ করে?
বায়ু দূষণকারী পদার্থের নাম | কোন কোন মৌলের সমন্বয়ে সৃষ্ট | কোন ধরনের রাসায়নিক বন্ধন | উত্তরের পক্ষে যুক্তি কী? |
কার্বন মনোক্সাইড (CO) | C ও O | সমযোজী | C ও O পরমাণু ইলেক্ট্রন ভাগাভাগি করে অষ্টক পূরণ করে |
ওজোন (O3) | O | সমযোজী | O পরমাণু পরস্পর ইলেক্ট্রন ভাগাভাগি করে অষ্টক পূরণ করে |
নাইট্রোজেন ডাই অক্সাইড(NO2) | N ও O | সমযোজী | N ও O পরমাণু ইলেক্ট্রন ভাগাভাগি করে অষ্টক পূরণ করে |
সালফার ডাই অক্সাইড(SO2) | S ও O | সমযোজী | S ও O পরমাণু ইলেক্ট্রন ভাগাভাগি করে অষ্টক পূরণ করে |
২১শ ও ২২শ সেশনঃ
CO, O3, NO2, SO2 ইত্যাদি বায়ু দূষণকারী যৌগ কোথায় তৈরি হয়,কী ধরনের রাসায়নিক বিক্রিয়ায় উৎপাদ হিসেবে তৈরি হয়? কী ধরনের কৌশল বা প্রযুক্তি কাজে লাগিয়ে এই ক্ষতিকর পদার্থ নি:সরণ বন্ধ করা সম্ভব?
তৈরীর স্থানঃ শিল্প কারখানার চুল্লী, জীবাশ্ম জ্বালানী পোড়ার ফলে, যানবাহনের উচ্চ তাপমাত্রায় জ্বালানী দহন, বন উজাড়, খনিজ পদার্থ প্রক্রিয়াজাতকরন ইত্যাদি।
ক্ষতিকর পদার্থ নির্গমন নিয়ন্ত্রণ:
প্রযুক্তি: ধোঁয়া নিয়ন্ত্রণ ব্যবস্থা: ইলেক্ট্রোস্ট্যাটিক প্রিসিপিটেটর, স্ক্রাবার, ফিল্টার ব্যবহার
জ্বালানী দক্ষতা বৃদ্ধি: উন্নত প্রযুক্তি ব্যবহার, জ্বালানীর পূর্ণ দহন নিশ্চিত করা
পরিবেশবান্ধব জ্বালানী ব্যবহার: : নবায়নযোগ্য জ্বালানী, CNG, LPG ব্যবহার
নিয়ন্ত্রণ ব্যবস্থা: কঠোর আইন প্রণয়ন ও বাস্তবায়ন, নিয়মিত পরিদর্শন
কৌশল:
সচেতনতা বৃদ্ধি: জনসাধারণকে বায়ু দূষণের ক্ষতিকর প্রভাব সম্পর্কে শিক্ষিত করা।
পরিবহন ব্যবস্থার উন্নয়ন: গণপরিবহন ব্যবস্থার উন্নয়ন, যানবাহনের নির্গমন নিয়ন্ত্রণ।
বৃক্ষরোপণ: বৃক্ষরোপণ বৃদ্ধি, বনায়ন আন্তর্জাতিক সহযোগিতা: বায়ু দূষণ নিয়ন্ত্রণে আন্তর্জাতিক সহযোগিতা বৃদ্ধি।
ভাবনার খোরাকঃClean energy বা “পরিচ্ছন্ন শক্তি” কি?
Clean energy” বা “পরিচ্ছন্ন শক্তি” হল এমন শক্তি যা উৎপাদনের সময় ক্ষতিকারক বায়ু দূষণকারী পদার্থ নিঃসরণ করে না। এটি সাধারণতঃ পুনঃনবায়নযোগ্য শক্তি উৎস থেকে উৎপাদিত হয়, যা প্রাকৃতিকভাবে পুনঃনির্মিত হয় এবং ক্ষীণ হয়ে যায় না। তবে, শুধু পুনঃনবায়নযোগ্য শক্তিই নয়, বরং যেকোনো এমন প্রযুক্তি বা পদ্ধতি যা কম বা কোনো দূষণ ছাড়াই শক্তি উৎপাদন করে তাকেই “clean energy” বলা যায়।
২৩শ সেশনঃ
 ভাবনার খোরাকঃ বাতাস থেকে উইন্ডমিলের মাধ্যমে শক্তি উৎপাদন করা হলে বায়ূদূষণ বাড়বে নাকি কমবে?
ভাবনার খোরাকঃ বাতাস থেকে উইন্ডমিলের মাধ্যমে শক্তি উৎপাদন করা হলে বায়ূদূষণ বাড়বে নাকি কমবে?
As an Amazon Associate I earn from qualifying purchases.

Leave a Reply